Identificação de átomos por suas ondas, propriedades das ondas e interação com o corpo humano
A abordagem que eu escolhi foi “a experimentação como caminho pedagógico” onde se utiliza a abordagem investigativa. O problema e o experimento proposto é o teste da chama, onde os alunos devem buscar uma explicação para o porquê da chama de diferentes compostos inorgânicos, em especial sais, terem diferentes cores. Para tanto os alunos receberão diferentes sais metálicos e deverão registrar a cor da chama de cada um deles. Procedimento: - acender o bico de Bunsen. - colocar amostras de cada um dos sais na chama do bico de Bunsen observar a cor e anotar o resultado. Após repetir o procedimento para todos os sais disponíveis os alunos chegarão à uma tabela semelhante a seguinte: ver imagem 1 (referências)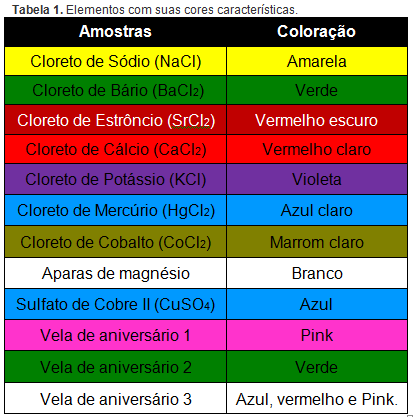 Vamos nos concentrar nos sete primeiros compostos desta tabela. Como podemos ver todos eles possuem o ânion cloreto, logo, sendo que o mesmo átomo não pode dar diferentes resultados no mesmo teste os alunos concluirão que os responsáveis pela coloração é o cátion metálico. O próximo passo é investigar o que torna a emissão de luz de cada átomo diferente. Essa investigação deve ser um pouco restrita, orientando os alunos a buscarem a resposta nos modelos atômicos. Isso levaria os alunos à uma compreensão maior desses modelos. Após eliminar os modelos de Dalton, Thomson e Rutherford os alunos se deparariam com o modelo de Bohr no qual consta o seguinte: No modelo de Bohr o átomo é composto por um núcleo central positivo e “orbitando” ao seu redor encontra-se o elétron. No entanto, o elétron só pode estar em níveis bem definidos chamadas órbitas, cada órbita possui uma certa quantidade de energia, quanto mais próxima do núcleo menor a energia e quanto mais distante maior a energia. Um elétron pode passar de um nível energético à outro contanto que absorva ou libere energia para ir para um nível mais energético ou voltar para um nível menos energético, respectivamente. A passagem de um elétron de um nível à outro é chamada de transição eletrônica e está representada na imagem 2.
Vamos nos concentrar nos sete primeiros compostos desta tabela. Como podemos ver todos eles possuem o ânion cloreto, logo, sendo que o mesmo átomo não pode dar diferentes resultados no mesmo teste os alunos concluirão que os responsáveis pela coloração é o cátion metálico. O próximo passo é investigar o que torna a emissão de luz de cada átomo diferente. Essa investigação deve ser um pouco restrita, orientando os alunos a buscarem a resposta nos modelos atômicos. Isso levaria os alunos à uma compreensão maior desses modelos. Após eliminar os modelos de Dalton, Thomson e Rutherford os alunos se deparariam com o modelo de Bohr no qual consta o seguinte: No modelo de Bohr o átomo é composto por um núcleo central positivo e “orbitando” ao seu redor encontra-se o elétron. No entanto, o elétron só pode estar em níveis bem definidos chamadas órbitas, cada órbita possui uma certa quantidade de energia, quanto mais próxima do núcleo menor a energia e quanto mais distante maior a energia. Um elétron pode passar de um nível energético à outro contanto que absorva ou libere energia para ir para um nível mais energético ou voltar para um nível menos energético, respectivamente. A passagem de um elétron de um nível à outro é chamada de transição eletrônica e está representada na imagem 2. 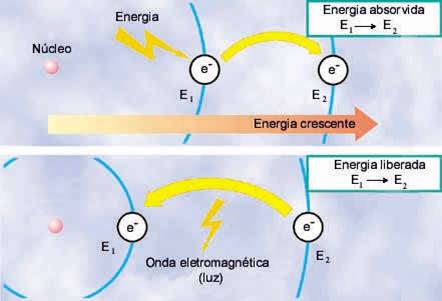 Um elétron sempre tende aos estados menos energéticos, ou seja, sempre voltará à órbita com menos energia. Assim o que acontece no teste da chama corresponde a transição eletrônica de cada átomo metálico. Imagine que o elétron do cátion metálico do sal encontra-se na órbita mais próxima do núcleo, como na figura acima. A chama corresponde à energia necessária para que o elétron passe para o nível com mais energia ou estado excitado. Como o elétron tende sempre ao estado de menor energia, assim que ele passar para o estado excitado emitirá energia para voltar ao nível anterior. A energia emitida é justamente a diferença que existe entre os dois níveis e essa diferença de energia é emitida em forma de luz com as diferentes cores observadas. Então o que faz com que um átomo emita luz diferente de outro é o modo como os seus níveis energético, a eletrosfera, está estruturada. Essa estrutura é tão característica de cada átomo que é possível identificá-los através de suas transições eletrônicas. O átomo é objeto de estudo tanto da Química quanto da Física, mas a partir desse ponto podemos estudar de modo interdisciplinar um fato que corresponde apenas à Física, as ondas. A energia que foi liberada pelo elétron em forma de luz é uma onda eletromagnética que não precisa de um meio para se propagar, ou seja, podem se propagar no vácuo. As ondas transmitem energia e possuem algumas propriedades básicas como comprimento de onda, frequência e período. O comprimento de uma onda é a distância entre dois pontos semelhantes e consecutivos na própria onda, que é comumente representada pela letra grega λ, assim como é representado na imagem 3.
Um elétron sempre tende aos estados menos energéticos, ou seja, sempre voltará à órbita com menos energia. Assim o que acontece no teste da chama corresponde a transição eletrônica de cada átomo metálico. Imagine que o elétron do cátion metálico do sal encontra-se na órbita mais próxima do núcleo, como na figura acima. A chama corresponde à energia necessária para que o elétron passe para o nível com mais energia ou estado excitado. Como o elétron tende sempre ao estado de menor energia, assim que ele passar para o estado excitado emitirá energia para voltar ao nível anterior. A energia emitida é justamente a diferença que existe entre os dois níveis e essa diferença de energia é emitida em forma de luz com as diferentes cores observadas. Então o que faz com que um átomo emita luz diferente de outro é o modo como os seus níveis energético, a eletrosfera, está estruturada. Essa estrutura é tão característica de cada átomo que é possível identificá-los através de suas transições eletrônicas. O átomo é objeto de estudo tanto da Química quanto da Física, mas a partir desse ponto podemos estudar de modo interdisciplinar um fato que corresponde apenas à Física, as ondas. A energia que foi liberada pelo elétron em forma de luz é uma onda eletromagnética que não precisa de um meio para se propagar, ou seja, podem se propagar no vácuo. As ondas transmitem energia e possuem algumas propriedades básicas como comprimento de onda, frequência e período. O comprimento de uma onda é a distância entre dois pontos semelhantes e consecutivos na própria onda, que é comumente representada pela letra grega λ, assim como é representado na imagem 3. 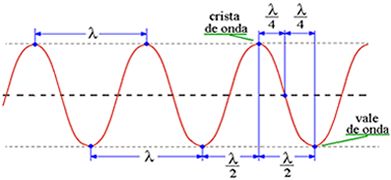 O tempo que uma onda leva para percorrer um comprimento de onda é chamado de período, T, e é dado em segundos. Por fim, o inverso do período é chamado de frequência (f) que mede o número de oscilações por segundo, sua unidade é o Hz (hertz). Assim, f= 1/T Observe na imagem 4 a seguir como a onda de cima tem mais oscilações que a onda de baixo quando comparados intervalos de tempo iguais, ou seja, a onda de cima tem maior frequência que a de baixo.
O tempo que uma onda leva para percorrer um comprimento de onda é chamado de período, T, e é dado em segundos. Por fim, o inverso do período é chamado de frequência (f) que mede o número de oscilações por segundo, sua unidade é o Hz (hertz). Assim, f= 1/T Observe na imagem 4 a seguir como a onda de cima tem mais oscilações que a onda de baixo quando comparados intervalos de tempo iguais, ou seja, a onda de cima tem maior frequência que a de baixo. 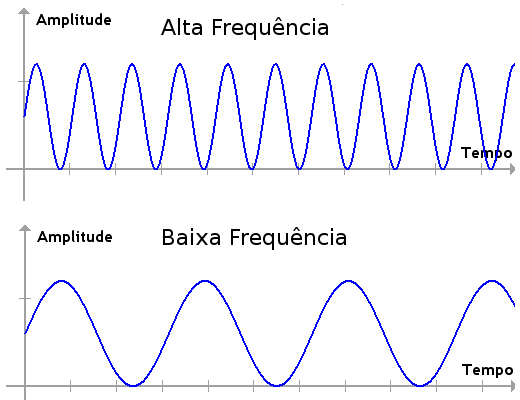 As ondas também podem ser mecânicas, isto é, aquelas que precisam de meio para se propagar, seja líquido, sólido ou gasoso. A onda mecânica mais comum é a sonora. Os seres humanos e vários animais reconhecem os sons com o sentido da audição, que faculta a determinação da distância e localização da fonte sonora. O ouvido humano apenas consegue detectar sons com uma frequência entre 20 Hz a 20.000 Hz, porém o limite maior costuma diminuir com a idade. Acima e abaixo deste intervalo referido acima, apresentam-se o ultra e infra som. Os sons considerados “graves” são os sons com frequências mais baixas (vibrações lentas) e os sons considerados “agudos” são os sons com frequências mais elevadas (vibrações rápidas). As ondas são emitidas de uma fonte sonora qualquer e chegam até o nosso aparelho auditivo fazendo vibrar o tímpano, que por sua vez fará vibrar três minúsculos ossos chamados martelo, bigorna e estribo. Tais vibrações são passadas para a cóclea e viram impulsos nervosos que através do nervo auditivo são transmitidos ao cérebro. O ouvido divide-se em ouvido externo, médio e interno. Ouvido Externo: Formado pelo pavilhão e canal auditivo Ouvido Médio: local em que estão contidos 3 ossículos, martelo, bigorna e estribo. Esses ossos são responsáveis por levar as ondas de um meio com menor impedância, o ar, para um com maior impedância, líquido. Impedância e a capacidade de oferecer resistência a uma transferência. Ouvido Interno: É chamado também de labirinto. Fazem parte do labirinto a cóclea citada acima, vestíbulos, canais semicirculares (relacionados ao equilíbrio) dentre outros.
As ondas também podem ser mecânicas, isto é, aquelas que precisam de meio para se propagar, seja líquido, sólido ou gasoso. A onda mecânica mais comum é a sonora. Os seres humanos e vários animais reconhecem os sons com o sentido da audição, que faculta a determinação da distância e localização da fonte sonora. O ouvido humano apenas consegue detectar sons com uma frequência entre 20 Hz a 20.000 Hz, porém o limite maior costuma diminuir com a idade. Acima e abaixo deste intervalo referido acima, apresentam-se o ultra e infra som. Os sons considerados “graves” são os sons com frequências mais baixas (vibrações lentas) e os sons considerados “agudos” são os sons com frequências mais elevadas (vibrações rápidas). As ondas são emitidas de uma fonte sonora qualquer e chegam até o nosso aparelho auditivo fazendo vibrar o tímpano, que por sua vez fará vibrar três minúsculos ossos chamados martelo, bigorna e estribo. Tais vibrações são passadas para a cóclea e viram impulsos nervosos que através do nervo auditivo são transmitidos ao cérebro. O ouvido divide-se em ouvido externo, médio e interno. Ouvido Externo: Formado pelo pavilhão e canal auditivo Ouvido Médio: local em que estão contidos 3 ossículos, martelo, bigorna e estribo. Esses ossos são responsáveis por levar as ondas de um meio com menor impedância, o ar, para um com maior impedância, líquido. Impedância e a capacidade de oferecer resistência a uma transferência. Ouvido Interno: É chamado também de labirinto. Fazem parte do labirinto a cóclea citada acima, vestíbulos, canais semicirculares (relacionados ao equilíbrio) dentre outros. 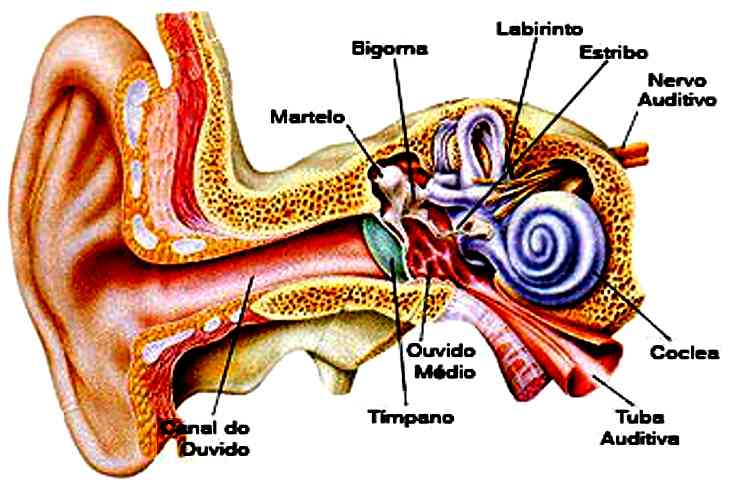 Na imagem 5 temos uma representação do sistema auditivo.
Na imagem 5 temos uma representação do sistema auditivo.
Referência
http://clube-ciencia.blogspot.com.br/2013/09/teste-da-chama.html http://www.mundoeducacao.com/fisica/velocidade-comprimento-onda.htm https://anasoares1.wordpress.com/2011/01/31/som-e-caracteristicas-do-som... http://radaudiovisual.blogspot.com.br/2013/01/eu-ovo-e-tu-como-percebemo...
- Logue-se para poder enviar comentários



Comments
imagem
por que minhas imagens não aparecem?
Inserir Imagem
Olá, Daniel! Você publicou as imagens corretamente no formulário. Faltou, contudo, clicar em "inserir" em cada uma das imagens. Tomei a liberdade de habilitar as imagens. Verifique se ficou legal, ok?
Aproveito para sugerir que publique a atividade proposta em nossa "Galeria de Experiências" do Portal. A galeria foi pensada para compartilhar propostas e relatos sobre a aplicação nas escolas entre todos os usuários do Portal. Segue o llink: http://www.emdialogo.uff.br/experiencias/home
Abraços,
Paulo Carrano
Equipe do Portal EMdiálogo.